Kimia Kelas 10: Konsep Dasar Stoikiometri dan Jenis-Jenisnya

Siapa nih di antara Pahamifren yang pernah mengamati pemupukan tanaman? Saat memupuk tanaman, konsentrasi pengenceran pupuk harus sesuai pada perbandingan tertentu. Tidak boleh terlalu pekat atau encer. Biasanya, hal ini dilakukan agar proses metabolisme di dalam tubuh tanaman tidak terganggu. Nah, untuk mengetahui komposisi unsur kimia yang pas di dalam pupuk dibutuhkan perhitungan stoikiometri.
Stoikiometri merupakan mata pelajaran Kimia kelas 10. Materi Kimia Stoikiometri ini selalu muncul dalam tes UTBK SBMPTN, lho. Buat kamu yang sedang melakukan persiapan UTBK, wajib banget menguasai materi ini. Yuk, simak rangkuman materi Kimia Stoikiometri berikut ini!
Materi Kimia Stoikiometri
Stoikiometri berasal dari kata “stoicheion” dalam bahasa Yunani yang berarti mengukur. Dalam ilmu kimia, stoikiometri adalah ilmu yang mempelajari kuantitas suatu zat dalam reaksi kimia. Zat-zat tersebut meliputi massa, jumlah mol, volume, dan jumlah partikel. Tak hanya itu, stoikiometri juga diartikan sebagai perhitungan kimia yang menyangkut hubungan kuantitatif zat yang terlibat dalam reaksi.
Suatu reaksi kimia dapat dikatakan sebagai reaksi stoikiometri apabila reaktan dalam reaksi habis seluruhnya. Adapun rumus-rumus yang biasa digunakan dalam menyelesaikan materi Kimia Stoikiometri adalah sebagai berikut:
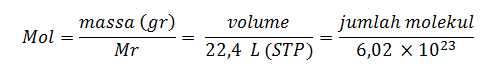
Angka 22,4 L merupakan volume gas ideal dalam keadaan STP (Standard Temperature and Pressure), dengan tekanan gas (P) = 1 atm, dan suhu (T) = 273 K. Sementara angka 6,02 x 1023 merupakan besaran tetapan Avogadro. Jadi, 1 mol zat apa pun memiliki jumlah partikel yang sama yaitu sebanyak 6,02 x 1023 partikel.
Hukum Dasar Kimia untuk Stoikiometri
Ada beberapa hukum dasar kimia yang digunakan untuk stoikiometri, yaitu hukum kekekalan massa, hukum perbandingan tetap, hukum perbandingan berganda, hukum Boyle, hukum Gay Lussac, dan Hipotesis Avogadro. Mari kita bahas satu per satu hukum dasar kimia tersebut.
Hukum Kekekalan Massa
Hukum ini menyatakan massa total suatu bahan sesudah reaksi kimia sama dengan massa total bahan sebelum reaksi. Contohnya, massa kayu yang belum dibakar memiliki massa yang sama dengan hasil pembakarannya.
Hukum Perbandingan Tetap
Hukum yang dicetuskan oleh Joseph Proust pada tahun 1799 ini menyatakan perbandingan massa unsur-unsur penyusun suatu senyawa selalu tetap. Contohnya, perbandingan massa Hidrogen dan Oksigen dalam air adalah 1:8, tidak bergantung pada jumlah air yang dianalisis.
Hukum Perbandingan Berganda
Hukum perbandingan berganda yang dikemukakan oleh John Dalton pada tahun 1803 yaitu apabila ada dua unsur yang dapat membentuk lebih dari satu senyawa, perbandingan massa unsur yang satu, yang bersenyawa dengan unsur lain yang tertentu massanya adalah bilangan bulat dan sederhana. Contohnya, jika Hidrogen yang bereaksi masing-masing 1 gram, H2O (air) yang terbentuk akan mengandung 4 gram oksigen, dan 8 gram pada H2O2 (Hidrogen Peroksida).

Hukum Gay Lussac
Hukum Gay Lussac atau yang dikenal juga dengan Hukum Perbandingan Volume dicetuskan oleh ilmuwan asal Prancis, yaitu Joseph Gay Lussac. Berdasarkan penelitiannya, Lussac mengambil kesimpulan bahwa perubahan volume gas dipengaruhi oleh suhu dan tekanan. Contohnya, pada suhu dan tekanan tertentu, 1 liter gas Nitrogen bisa bereaksi dengan 3 liter gas Hidrogen, hingga menghasilkan 2 liter gas amonia (2NH3).
Hipotesis Avogadro
Hipotesis Avogadro ini melengkapi hukum dasar kimia yang digunakan untuk stoikiometri. Seorang ilmuwan asal Italia, Amadeo Avogadro menyatakan bahwa partikel unsur tidak selalu berupa atom yang berdiri sendiri, melainkan bisa berbentuk molekul unsur. Contohnya, H2, O2, N2, dan P4.
Berdasarkan pemikiran tersebut, Avogadro berhasil menjelaskan hukum Gay Lussac dan membuat hipotesis, yaitu pada tekanan dan suhu yang sama, perbandingan gas yang memiliki jumlah volume sama akan mempunyai jumlah molekul yang sama pula.
Konsep Kimia yang Harus Dipahami dalam Stoikiometri
Untuk mempelajari materi Kimia Stoikiometri, kamu harus dapat memahami konsep-konsep kimia berikut ini:
Massa Atom Relatif (Ar)
Massa atom relatif merupakan perbandingan massa suatu atom dengan 1/12 kali massa suatu atom isotop karbon-12 atau C-12. Isotop C-12 ini digunakan sebagai standar karena mempunyai kestabilan inti yang inert dibandingkan dengan atom lainnya.
Massa Molekul Relatif (Mr)
Berbeda dengan atom relatif, massa molekul relatif digunakan untuk mencari perbandingan massa satu molekul senyawa dengan 1/12 kali massa satu atom isotop karbon-12 atau C-12. Dalam hal ini, molekul merupakan gabungan dari atom-atom suatu unsur. Jadi, Mr merupakan jumlah Ar atom-atom penyusunnya, atau dapat dirumuskan dengan Mr = ΣAr.
Konsep Mol
Dalam konsep mol, satu mol suatu zat dinyatakan sebagai banyaknya zat tersebut yang mengandung 6,02 x 1023 buah partikel. Hubungan mol dan jumlah partikel tersebut ditetapkan sesuai hipotesis Avogadro. Selain itu, massa satu mol suatu zat tersebut sama dengan Ar atau Mr yang dinyatakan dalam gram. Contohnya, Ar C = 12 sma, maka massa molar karbon = 12 gram/mol.
Molaritas
Molaritas adalah jumlah mol zat terlarut dalam setiap 1 liter larutan. Konsep molaritas ini sering dikaitkan dengan stoikiometri larutan. Umumnya, molaritas dirumuskan dengan M = n/V (volume).
Jenis-Jenis Stoikiometri Kimia
Ada tiga macam stoikiometri dalam ilmu Kimia, antara lain stoikiometri reaksi, komposisi (senyawa), dan stoikiometri gas. Berikut penjelasan jenis-jenis stoikiometri tersebut:
- Stoikiometri reaksi: Membahas tentang hubungan kuantitatif antara zat yang terlibat dalam suatu reaksi kimia. Stoikiometri reaksi sering digunakan untuk menyetarakan persamaan reaksi.
- Stoikiometri komposisi: Membahas tentang hubungan kuantitatif massa atau jumlah zat antarunsur dalam suatu senyawa. Dalam penerapannya, stoikiometri ini sering digunakan untuk menggambarkan jumlah zat Nitrogen dan Hidrogen yang bergabung menjadi amonia kompleks (NH3).
- Stoikiometri gas: Jenis stoikiometri ini berkaitan dengan reaksi kimia yang melibatkan gas, di mana gas pada suhu, tekanan, dan volume tertentu dianggap sebagai gas ideal. Persamaan gas ideal sering dirumuskan dengan PV = nRT (P = tekanan dalam satuan atm, V = volume gas dalam satuan liter, n = jumlah mol, R = tetapan gas 0,082 L atm/mol K, dan T = suhu 273 K).

Contoh Soal Stoikiometri dan Pembahasan
Setelah mengetahui konsep dasar materi Kimia Stoikiometri dan jenis-jenisnya, sekarang saatnya kamu mengetahui contoh soal stoikiometri dan pembahasannya. Soal yang akan Mipi ulas ini termasuk soal HOTS UTBK. Jadi, buat kamu pejuang UTBK, yuk coba kerjakan soalnya sekarang agar persiapan UTBK semakin matang!
Suatu senyawa dengan ![]() mengandung 40% massa unsur
mengandung 40% massa unsur ![]() dan sisanya unsur
dan sisanya unsur ![]() . Rumus molekul senyawa tersebut adalah…
. Rumus molekul senyawa tersebut adalah…
A. ![]()
B. ![]()
C. ![]()
D. ![]()
E. ![]()
Pembahasan:
Hukum perbandingan berganda yang dikeluarkan oleh Dalton berbunyi jika dua unsur dapat membentuk dua senyawa atau lebih, maka perbandingan massa unsur satu yang bersenyawa dengan kedua massa sama akan berbanding sebagai bilangan sederhana.
Misalnya massa senyawa ![]() dan
dan ![]() , maka
, maka
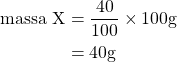
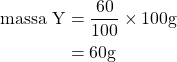
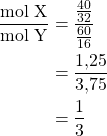
Jadi, rumus molekul senyawanya adalah ![]() . Jawaban yang benar adalah E.
. Jawaban yang benar adalah E.
Nah, itulah rangkuman materi Kimia Stoikiometri yang bisa kamu pelajari. Buat kamu yang ingin mendapatkan materi Kimia SMA secara lengkap, kamu bisa mengunduh aplikasi belajar online Pahamify. Kamu juga bisa mencoba latihan soal UTBK Kimia di fitur Try Out Pahamify. Ada ratusan latihan soal UTBK TPS dan TKA ter-update, lengkap dengan video pembahasan yang menarik.
Ayo, lebih siap taklukkan UTBK dan raih PTN impian bersama Pahamify! Download aplikasi Pahamify di sini dan gunakan semua fitur keren Pahamify untuk mendapatkan proses belajar seru dan menyenangkan.
Penulis: Fitri Dewanty – SEO Content Writer Pahamify

Reski SAPUTERA RAHAMADANI
July 28, 2021 at 3:36 amSaya paham
Salsabila
October 11, 2021 at 3:55 amterimakasih banyak kak
Fitri
January 13, 2022 at 1:29 pmMakasih