Fisika – Teori Atom

Sejak 2500 tahun yang lalu, manusia sudah mencari tahu apa partikel terkecil yang ada di alam semesta dan bagaimana bentuknya. Dua orang filsuf pada zaman Yunani kuno, Democritus dan Leucippus, adalah orang pertama yang mengemukakan ide mengenai partikel terkecil ini. Mereka menyebutkan bahwa atom adalah unit terkecil penyusun semua materi yang ada di sekitar kita. Karena atom adalah unit terkecil, atom tidak bisa dibagi atau diubah lagi.
Sayangnya, gagasan ini mendapat banyak kritik dari filsuf-filsuf lain. Salah satunya adalah Aristoteles. Menurut Aristoteles, segala sesuatu yang ada di dunia ini bisa dibagi, sehingga tidak mungkin ada istilah “atom” yang artinya “tidak terbagi”. Pendapat Aristoteles ini banyak didukung oleh filsuf-filsuf lainnya. Akibatnya, gagasan mengenai atom tidak pernah lagi berkembang selama berabad-abad lamanya.
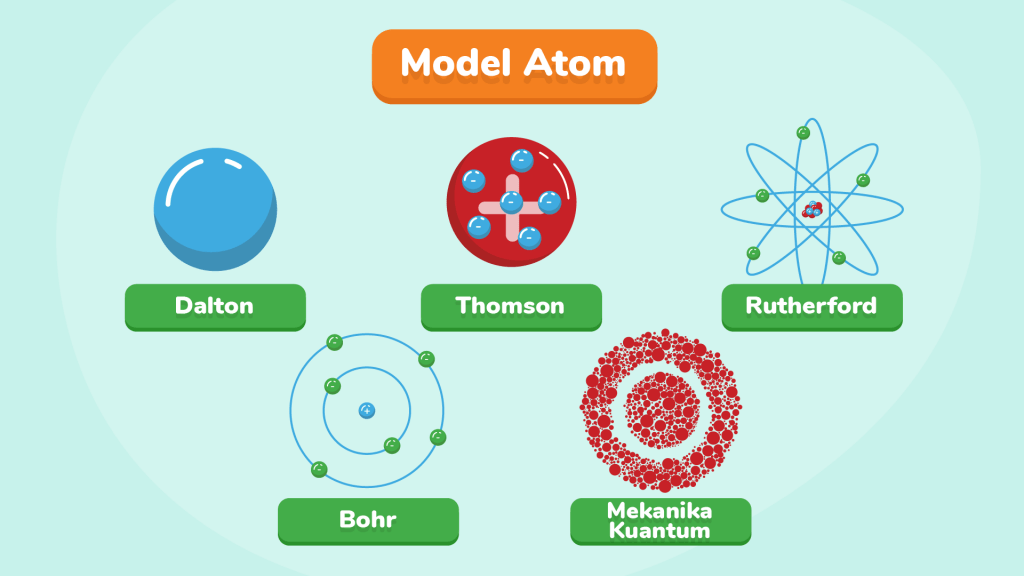
A. TEORI ATOM DALTON (1802)
Gagasan mengenai atom kembali muncul pada tahun 1802 di Eropa ketika ilmuwan asal Inggris bernama John Dalton merumuskan teori atom yang pertama. Teori ini kemudian dikenal sebagai Teori Atom Dalton.
Dalton mengemukakan empat pendapat.
1. Atom merupakan bagian terkecil dari materi yang tidak dapat dibagi lagi. Hal ini sesuai dengan gagasan yang sebelumnya telah dikemukakan oleh Democritus dan Leucippus.
2. Dalton mengemukakan model atom pertama yang berbentuk seperti bola pejal. Dalton mengemukakan bahwa atom berbentuk seperti bola pejal yang sangat kecil dan setiap unsur memiliki atom-atom yang identik dan berbeda untuk membentuk unsur yang berbeda.
3. Atom-atom bergabung membentuk senyawa dengan perbandingan bulat dan sederhana. Seperti air yang terbentuk dari atom-atom oksigen dan atom-atom hidrogen.
4. Reaksi kimia merupakan pemisahan atau penggabungan atau penyusunan kembali dari atom-atom, sehingga atom tidak dapat diciptakan atau dimusnahkan.
Teori yang dikemukakan oleh Dalton membangkitkan kembali minat penelitian terhadap atom. Dikarenakan atom pada saat itu tidak bisa dilihat secara langsung, para peneliti hanya dapat mengamati sifat-sifat yang ditimbulkan oleh atom.
B. TEORI ATOM THOMSON (1904)
Salah satu peneliti yang tertarik untuk meneliti tentang atom setelah John Dalton adalah Joseph JJ. Thomson, seorang fisikawan yang juga berasal dari Inggris. Thomson melakukan sebuah percobaan untuk mencari tahu muatan apa saja yang terkandung dalam atom.
Thomson melakukan percobaan menggunakan tabung katode, yaitu sebuah tabung yang sebagian besar udaranya telah disedot keluar. Pada pangkal tabung ditempelkan dua lempeng logam dengan muatan yang berbeda. Lempeng tersebut kemudian dihubungkan dengan sumber tegangan tingkat tinggi. Dari sumber tersebut muncul sinar yang merambat sampai ke ujung tabung. Ketika sinar tersebut menabrak permukaan tabung, muncul cahaya yang terang.
Selanjutnya, Thomson meletakkan dua lempeng berbeda muatan tadi pada masing-masing sisi tabung. Pada satu sisi, ditempelkan lempeng logam bermuatan positif, sementara pada sisi yang lain, ditempelkan lempeng logam bermuatan negatif. Kemudian Thomson melakukan percobaan yang sama. Namun kali ini, arah sinar yang muncul malah berbelok ke arah lempeng yang bermuatan positif alih-alih merambat lurus.
Berdasarkan percobaan tersebut Thomson berkesimpulan bahwa dalam atom terdapat sesuatu yang bermuatan negatif. Hal ini didasarkan pada sifat muatan yang berbeda akan saling tarik-menarik. Thomson kemudian menamakan partikel yang bermuatan negatif ini sebagai elektron.
Thomson juga berkesimpulan bahwa atom masih bisa dibagi lagi menjadi partikel yang lebih kecil yang disebut partikel subatomik. Karena sebagian besar unsur yang ada di alam bersifat netral, Thomson berpendapat bahwa atom juga memiliki bagian yang bermuatan positif.
Thomson kemudian mengajukan model atom terbaru. Thomson menyetujui pendapat Dalton bahwa atom berbentuk seperti bola pejal yang bermuatan positif, namun muatan positif ini dinetralkan oleh elektron yang menyebar rata di dalamnya. Thomson mengibaratkan model atom yang dikemukakannya seperti roti kismis dengan roti yang mengibaratkan muatan positif dan kismis yang menngibaratkan muatan negatif.
C. TEORI ATOM RUTHERFORD (1911)
Beberapa tahun kemudian, fisikawan asal New Zealand, Ernest Rutherford, bersama dua muridnya Ernest Masden dan Hans Geiger, melakukan serangkaian percobaan untuk mengetahui susunan atom. Percobaan dilakukan dengan menembakkan sinar alfa, yaitu sinar yang berisikan partikel-partikel bermuatan positif, melalui lempeng emas yang sangat tipis. Sinar alfa ini akan tertarik ke muatan negatif dan akan menolak muatan yang positif.
Ketika sinar alfa tersebut ditembakkan, ternyata ada sebagian partikel yang dibelokkan dan bahkan ada partikel yang hampir dipantulkan balik, walau hanya sebagian. Berdasarkan percobaan tersebut Rutherford kemudian menduga bahwa dalam lempeng emas tersebut terdapat partikel positif. Namun, karena hanya sebagian sinar alfa yang dibelokkan dan dipantulkan, Rutherford berkesimpulan bahwa muatan positif tersebut terpusat di tengah atom. Partikel bermuatan positif kemudian dinamakan proton.
Dari percobaan tersebut Rutherford kemudian mengajukan model atom baru. Menurutnya, atom terdiri atas muatan positif yang berkumpul di bagian tengah yang disebut sebagai inti atom. Berdasarkan percobaan tersebut ditemukan bahwa 1 dari 20.000 partikel alfa akan dibelokkan. Bila perbandingan 1:20.000 merupakan perbandingan diameter, maka didapatkan ukuran inti atom kira-kira 10.000 lebih kecil daripada ukuran atom keseluruhan. Kemudian elektron-elektron beredar mengelilingi inti atom dengan jarak yang berjauhan. Rutherford juga mengatakan bahwa sebagian besar isi atom adalah ruang hampa.
Teori atom Rutherford ini mendapat kritik dari ilmuwan-ilmuwan lainnya. Ilmuwan lain berpendapat jika elektron terus menerus mengitari inti elektron, energi elektron akan berkurang dan gerakannya akan melambat. Akhirnya energi elektron akan habis dan elektron akan jatuh ke inti atom. Namun sayangnya Rutherford tidak dapat menjelaskan mengapa energi elektron tidak habis dan jatuh ke inti atom.
D. TEORI ATOM BOHR (1913)
Percobaan Rutherford kemudian dilanjutkan oleh Niels Bohr, seorang fisikawan asal Denmark. Lewat percobaannya, Bohr mencoba membuktikan bahwa energi elektron tidak akan habis dan jatuh ke inti atom. Bohr melakukan percobaannya dengan menggunakan spektrum atom hidrogen. Dari hasil percobaannya, Bohr memberikan gambaran keadaan/kedudukan orbit elektron dalam menempati daerah di sekitar inti atom. Bohr berpendapat bahwa elektron mengelilingi inti atom pada orbit/lintasan tertentu, dan hanya terdapat orbit dalam jumlah tertentu dan perbedaan antara orbit satu dengan yang lain adalah jarak orbit dari inti atom.
Keberadaan elektron, baik di orbit yang rendah maupun yang tinggi sepenuhnya bergantung pada tingkatan energi elektron. Elektron di orbit yang rendah akan memiliki energi yang lebih kecil daripada elektron di orbit yang lebih tinggi.
Bohr kemudian menggabungkan hasil percobaannya dengan teori dari Rutherford dan teori kuantum Planck. Bohr kemudian mendapatkan empat kesimpulan, yaitu
1. Elektron dalam atom bergerak mengelilingi inti pada lintasan-lintasan tertentu, tidak memancarkan energi. Lintasan-lintasan elektron itu disebut kulit atau tingkat energi elektron.
2. Elektron dapat berpindah dari satu lintasan ke lintasan yang lain.
3. Perpindahan elektron dari tingkat energi tinggi ke rendah disertai pemancaran energi. Sedang perpindahan elektron dari tingkat energi rendah ke tinggi disertai penyerapan energi.
4. Elektron yang bergerak pada lintasannya berada pada keadaan stasioner, artinya elektron tidak memancarkan atau menyerap energi.
Bohr kemudian mengajukan model atom yang mirip dengan sistem tata surya, di mana inti atom yang bermuatan positif dikelilingi oleh elektron yang ada di kulit atom. Persis seperti matahari yang dikelilingi oleh planet-planetnya.
Seperti teori-teori sebelumnya, teori atom Bohr juga memiliki kekurangan. Jika elektron hanya mengelilingi satu lintasan saja, maka posisi elektron tidak dapat diprediksi. Sayangnya Bohr tidak mampu menjelaskan hal tersebut.
E. TEORI MEKANIKA KUANTUM (1926)
Teori mekanika kuantum diperkenalkan oleh fisikawan asal Austria Erwin Schrodinger (yang juga terkenal dengan eksperimen pikiran terkenal “Kucing Schrodinger”) dan fisikawan asal Jerman Werner Heisenberg. Mereka berpendapat bahwa posisi elektron tidak hanya ada di lintasan-lintasan sehingga tidak bisa ditentukan posisinya secara pasti. Namun posisi elektron dapat diprediksi melalui peluang keberadaan elektron. Daerah yang memiliki peluang yang besar disebut dengan orbital.
Schrodinger dan Heisenberg kemudian mengajukan model atom yang sampai saat ini masih digunakan. Dalam model ini, atom terdiri dari inti atom yang bermuatan positif dan dikelilingi oleh elektron-elektron yang berada pada orbital-orbital.
Ternyata, butuh waktu yang sangat lama ya, untuk dapat memahami atom dan bagian-bagiannya. Kalau kamu masih penasaran, kamu bisa membaca penjelasan yang lebih detail mengenai teori atom yang tentunya dibahas lebih lengkap dan seru melalui video pembelajaran di aplikasi belajar online Pahamify.
Yuk, download dan langganan Pahamify sekarang!
